









準備するもの
【使用器具・薬品】
・ EDTA(エチレンジアミン四酢酸二ナトリウム)(1.86g)
・ EBT(エリオクロームブラックT)(0.1g)
・ 塩化ヒドロキシルアンモニウム(0.9g)
・ エタノール(20mL)
・ 塩化アンモニウム(33.8g)
・ アンモニア水(285mL)
・ コニカルビーカー(200mL)
・ ビュレット(25mL)
・ メスシリンダー(100mL)
・ スポイド
・ ビーカー
・ 市販のミネラルウォーター
【材料の入手】
・ EDTA(50g:1,150円)
・ EBT(25g:1,870円)
・ 塩化ヒドロキシルアンモニウム(25g:900円)
・ エタノール(500mL:1,400円)
・ 塩化アンモニウム(500g:1,200円)
・ アンモニア水(500mL:530円)
・ ミネラルウォーターは市販のものでよい
・ EDTA(エチレンジアミン四酢酸二ナトリウム)(1.86g)
・ EBT(エリオクロームブラックT)(0.1g)
・ 塩化ヒドロキシルアンモニウム(0.9g)
・ エタノール(20mL)
・ 塩化アンモニウム(33.8g)
・ アンモニア水(285mL)
・ コニカルビーカー(200mL)
・ ビュレット(25mL)
・ メスシリンダー(100mL)
・ スポイド
・ ビーカー
・ 市販のミネラルウォーター
【材料の入手】
・ EDTA(50g:1,150円)
・ EBT(25g:1,870円)
・ 塩化ヒドロキシルアンモニウム(25g:900円)
・ エタノール(500mL:1,400円)
・ 塩化アンモニウム(500g:1,200円)
・ アンモニア水(500mL:530円)
・ ミネラルウォーターは市販のものでよい























実験の手順
- EDTA1.86gを500mLの精製水に溶かす。
-
塩化アンモニウム33.8gを精製水150mLで溶かした後、
アンモニア水285mLを加え、さらに精製水を加えて500mLとする。 - EBT粉末0.1gと塩化ヒドロキシルアンモニウム0.9gをエタノール20mLで溶かす。(EBT指示薬)
- コニカルビーカーに試料100mLをはかりとる。
- さらにアンモニア緩衝溶液を2mL加える。(溶液のpHは10以上となる)
- 次にEBT指示薬を5~6滴加える。(溶液の色は赤紫色になる。)
-
ビュレットにEDTA溶液を入れ、試料中に滴下し、
溶液の色が完全に青色を呈した点を終点とする。

アドバイス
-
EBT指示薬を加えすぎると終点が見えにくくなるので、
うっすらと赤紫色になる程度でよい。 -
この実験では、水中のミネラル分を測定することにより、水の硬度を求めている。
水の硬度とは、「水中のカルシウムおよびマグネシウムの量をこれに対応する
炭酸カルシウムの濃度(mg/L)に換算して表したもの。」と定義されている。 -
この実験で得られる総硬度は以下のように算出する。
硬 度 = EDTAの滴定量×1000/試料100mL
(硬度は1リットル中の量として表すため1000をかける)

解説
この実験では金属イオンにEDTAを加え、金属キレート化合物を生成させ、
それをEBTのような金属指示薬で滴定しています。
EDTAは水に溶けにくいので通常今回のような二ナトリウム塩を用いるが、
その反応は以下のようになります。
M²⁺+H₂Y²⁻→MY²⁻+2H⁺
EDTAは金属イオンとキレートを作るときに水素イオンを放出するので溶液のpHが下がって
反応が進みにくくなります。
したがって、このpHを保つため、緩衝溶液中で滴定を行う必要があります。
●硬度について
日本の水の硬度は70~80程度、ヨーロッパアルプスの水は石灰質の地質が多いため、
ミネラル分が豊富で、それよりかなり高くなります。
硬度が高すぎる水を飲むと胃腸を壊して下痢を起こしたり、石鹸が泡立たなかったりします。
海外旅行をするとき生水を飲むなという理由はこんな所にもあるんです。
また、一般に硬度が300を越えると飲料水としては不適とされています。
水中のカルシウムおよびマグネシウムの成因は、主として地質からくるものですが、
海水、工場排水、下水などの混入によるものもあります。
水道においてはモルタルライニング管、施設のコンクリート構造物あるいは
水の石灰処理によって増加することもあります。
硬水、軟水の規定は特にありませんが、以下の表を参考にして下さい。
Kultの表
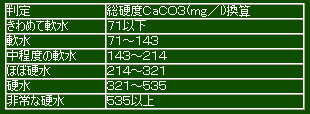
Threshの表

- コメント(0件)



































コメント投稿はログインしてから実行してください。
コメント投稿